 :"
:" "营养养殖实验后常常通过病菌感染实验来评估鱼体的健康(Lim等,2009).实际养殖中常见的嗜水气单胞菌经常被用在营养免疫实验中,感染嗜水气单胞菌后会出现出血性败血症状及溃疡性病变.在实际养殖中嗜水气单胞菌感染也是淡水鱼养殖高死亡率的原因之一,造成了巨大的经",:::"中国水产养殖网",::"淡水产品 草鱼",
"营养养殖实验后常常通过病菌感染实验来评估鱼体的健康(Lim等,2009).实际养殖中常见的嗜水气单胞菌经常被用在营养免疫实验中,感染嗜水气单胞菌后会出现出血性败血症状及溃疡性病变.在实际养殖中嗜水气单胞菌感染也是淡水鱼养殖高死亡率的原因之一,造成了巨大的经",:::"中国水产养殖网",::"淡水产品 草鱼",摘要:
本实验旨在评估饲料脂质水平对草鱼幼鱼生长、非特异性免疫及肝脏氧化状态的影响。在27.5±0.5℃水温下于水族箱循环系统中用5种不同脂质水平(0、25、50、75和100 g/kg饲料,其中鱼油/玉米油=1:1)的纯化饲料喂养初始体重为6.57±0.01 g的草鱼幼鱼10周。结果表明,50 g/kg饲料脂肪组的增重率最高,无脂对照组最低;饲料效率、蛋白质效率和增重率的变化模式一致;与无脂对照组相比,其它各组的非特异性免疫指标数值较好(如吞噬细胞活性、血浆过氧物酶活性和溶菌酶活性)且肝脏氧化程度较低,但是过量的饲料脂质水平会对肝脏造成代谢负担。在养殖实验结束后,对草鱼进行了嗜水气单胞菌(Aeromonas hydrophila)感染实验。结果显示,无脂对照组草鱼存活率最低;75 g/kg饲料组草鱼存活率最高,显著高于无脂对照组(P <0.05)。本实验研究表明适当的饲料脂质含量有助于提高草鱼免疫能力及细菌感染下的存活率,但是饲料脂质过量会增加草鱼肝脏氧化程度。增重率的二次回归曲线分析表明6.6-35.5 g大小的草鱼最适饲料脂质水平为65.3 g/kg。
1、前言
由于近年来饲料业的蓬勃发展及研究人员的不懈努力,目前草鱼商业饲料已基本可以满足草鱼快速生长的营养需要。然而不论是三大营养素还是微量营养素的需求量研究都是以生长情况或者是否导致缺乏症为标准(Lim等,2011),而不是以健康指标为参考,包括免疫应答和疾病抵抗。目前频繁爆发的疾病正严重威胁着高密度高产量养殖模式的发展。每年由于嗜水气单胞菌(Aeromonas hydrophila)的感染,中国草鱼养殖损失达数百万元。
通过营养补给来减轻疾病对水产养殖影响的观念已经越来越被大家接受(Viswanath,2012)。营养平衡,尤其是在仔鱼及幼鱼阶段,对生长、抗病及存活都有着深远的影响(Viswanath,2012)。脂质作为饲料中主要的能量来源,用于满足养殖品种的能量及必需脂肪酸需求。研究者在二十世纪早期发现摄食脂质对维持恒温动物的健康至关重要(Ziboh,2000),此后在变温动物也有相同发现(Takeuchi等,1977)。以往的研究主要集中在不同脂肪源或者必需脂肪酸对免疫应答或抗病能力的影响(Lim等,2008),然而饲料脂质水平与鱼类健康之间的关系所受的关注相对较少(Lim等,2009)。本实验旨在评估饲料脂质水平对草鱼幼鱼生长、肝抗氧化性及非特异性免疫应答的影响。
2、材料与方法
2.1 实验饲料
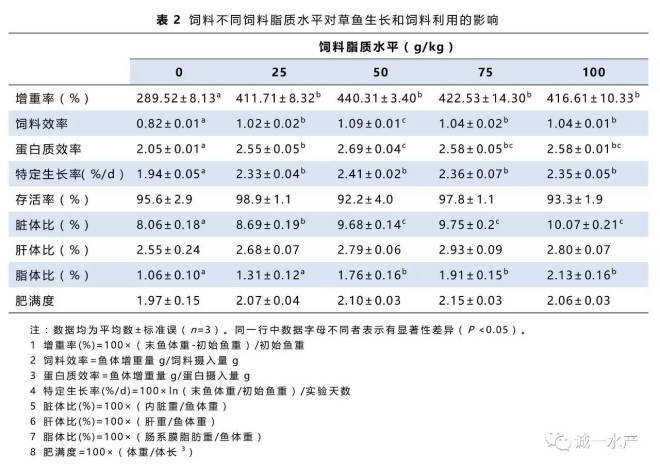
本实验共设计了5种不同脂肪含量的饲料,实验饲料配方和成分分析如表1所示。L0组为无脂对照组,L1,L2,L3,L4组中脂肪添加水平分别为25 g/kg,50 g/kg,75 g/kg,100 g/kg。实验饲料在常温下风干24小时后置-20℃冰箱保存。
2.2 实验鱼养殖和饲养管理
草鱼取自本实验室渔场,养殖实验开始前将鱼在室内循环水族箱中暂养2周以适应实验环境和操作,暂养期间投喂饲料L2。正式实验开始后,每箱(200 L)随机放鱼30尾,初始体重为6.57±0.01g。每组饲料设三个平行箱,按鱼体重的4%~5%确定每日投饲量,分别于9∶00和16∶00各投喂一次并观察鱼生长情况,记录死亡情况。每2周称一次总体重,并相应调整投喂量。饲养周期为10周。实验期水温为27.5±0.5℃,水中溶氧量7.5±0.43 mg/L,pH值为7.4±0.2,氨氮为0.079±0.005 mg/L,每日光照时间为12 h。
2.3 样品采集和体成分分析
实验结束后,将鱼禁食24h后,整箱鱼称重、清点尾数。每箱随机取鱼3尾供全鱼营养成分分析用,另取6尾,麻醉后分别称重,测量体重、体长,使用经过肝素钠处理过的注射器从围心腔取血,立即4℃离心(4000 r/min,10分钟),取上层血浆并置于-80℃冰箱保存;再把鱼解剖取得内脏,分离肝脏和肠系膜脂肪,分别称重记录,并剪取背部两侧白肌。
饲料及样品水分、粗蛋白、粗脂肪和灰分分别采用105℃常压干燥法、凯氏定氮法、索氏抽提法和550℃灼烧法测定。血浆甘油三酯、胆固醇及碱性磷酸酶(ALP)、谷草转氨酶(AST)和谷丙转氨酶(ALT)活性在三天内采用血液自动生化分析仪和相关试剂盒测定。
呼吸爆发的测定采用NBT法,以巨噬细胞产生的氧化自由基产物(ROS)来表示。血浆溶菌酶活性、氧化酶(POD)和肝脏超氧化物歧化酶(SOD)、丙二醛(MDA)及总抗氧化能力(T-AOC)活性采用试剂盒测定。
2.4 细菌应激实验
嗜水气单胞菌(Ah,BSK-10)按Alexander等(2011)的方法活化两次。实验取样结束一周后,每箱取10条鱼腹腔注射0.1 mL的菌悬浮液(LC50,6×108 CFU/mL)。另取10条草鱼腹腔注射同等剂量的PBS缓冲液做为负对照组。注射后正常投喂,在接下来的五天记录每天各组鱼死亡情况,并确认死亡原因。第六天计算存活率。
2.5 统计分析
实验结果用平均数±标准误表示,经ANOVA分析后,用Duncan’s多重比较法(Duncan,1955)分析各处理间的差异显著性(P <0.05)。所采用软件为SPSS13.0。
3、结果
3.1 生长、饲料利用、体组成及血浆酶分析
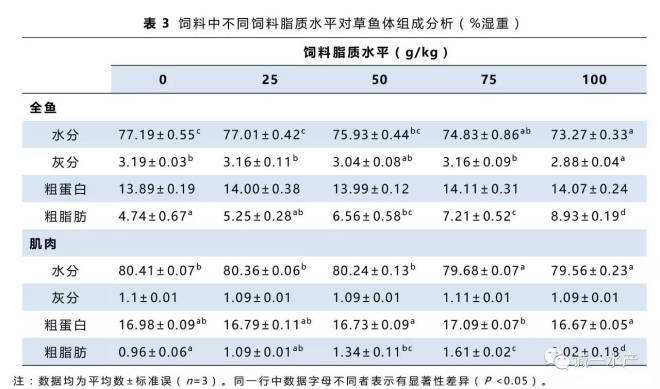
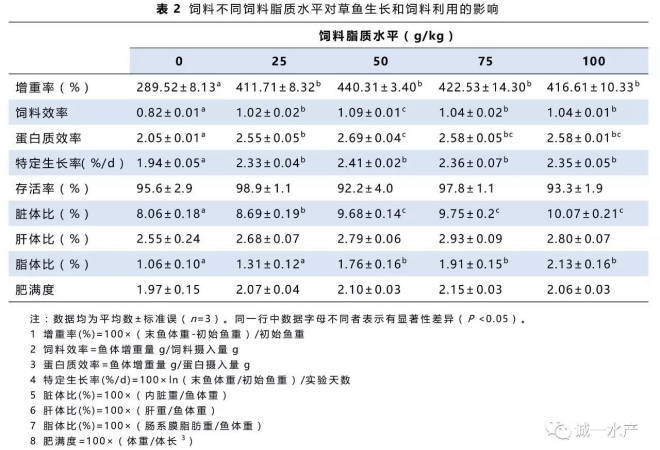
摄食不同饲料草鱼的增重率、饲料效率、蛋白质效率及存活率如表2所示。投喂不同脂质水平的饲料对存活率没有显著性影响(P >0.05)。50 g/kg饲料脂质水平组的草鱼增重率最高,其次是25 g/kg,75 g/kg和100 g/kg饲料脂质水平组,无脂对照组的增重率显著低于其它各组(P <0.05)。饲料效率及蛋白质效率的变化趋势和增重率相同。
50 g/kg、75 g/kg和100 g/kg饲料脂质水平组草鱼脏体比和脂体比显著高于其它各组,而无脂对照组最低。随着饲料脂质水平的提高,肝体比与肥满度均呈现上升趋势,但无显著性差异。
如表3所示,对照组和25 g/kg饲料脂质水平组全鱼水分和灰分都高于其它各组,100 g/kg饲料脂质水平组最低。相反,随着饲料脂质水平的升高,全鱼脂肪含量显著增加,100 g/kg饲料脂质水平组的全鱼脂肪含量显著高于其它各组。各组间肌肉水分与脂肪的变化与全鱼相似。各组间的全鱼蛋白均没有显著差异。
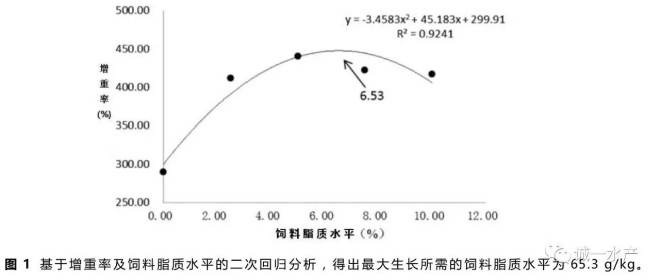
根据增重率及饲料脂质水平,通过二次回归方程式,计算得到草鱼饲料脂质需求量为65.3 g/kg(见图1)。二项式公式为:y=-3.4583x2+45.183x+299.91,R2=0.9241。

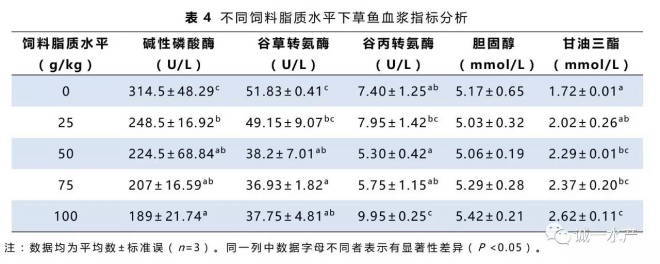
实验各组草鱼血浆中胆固醇、甘油三酯及相关酶活分析见表4。低饲料脂质摄入组的草鱼血浆中碱性磷酸酶、谷丙转氨酶和谷草转氨酶活性较高,但是甘油三酯及胆固醇含量较低。草鱼血浆胆固醇含量随着饲料脂质水平升高有上升趋势,而甘油三酯含量则随着脂肪摄入的提高而显著上升。碱性磷酸酶的活性呈现下降的趋势。谷丙转氨酶和谷草转氨酶的活性呈现先降后升的趋势,最低值出现在50~75 g/kg饲料脂质水平组。
3.2 肝脏受损情况测定
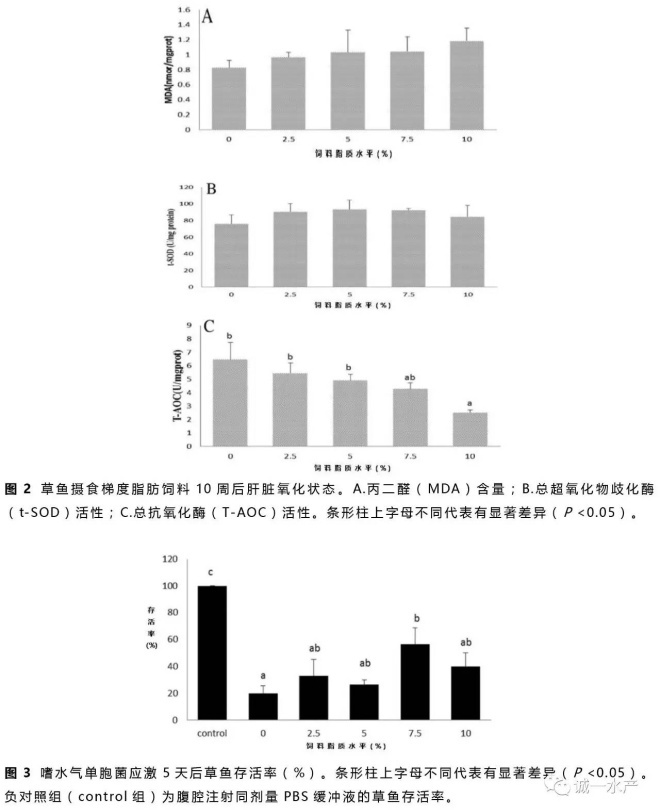
肝脏总超氧歧化酶(t-SOD)活性、丙二醛(MDA)含量及总抗氧化酶(T-AOC)活性分析结果见图2。肝脏MDA含量随着饲料脂质含量增加而增加(图2A),t-SOD活性各组间差异不显著(P >0.05,图2B),但是摄食50 g/kg饲料脂质的草鱼组t-SOD活性略高于其它各组。T-AOC活性随着饲料脂质含量从50 g/kg升到100 g/kg而显著降低(P <0.05),但在低于50 g/kg饲料脂质含量的各组间差异不显著(P >0.05,图2C)。
3.3 嗜水气单胞菌应激后存活率
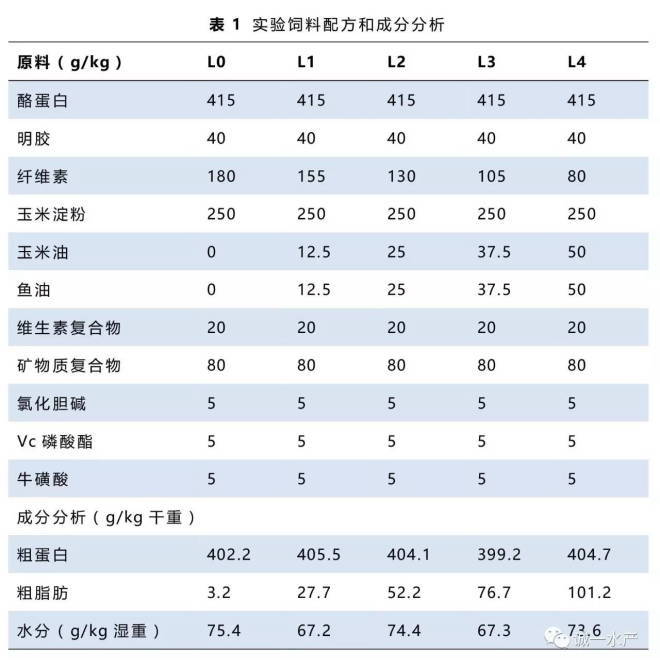
草鱼腹腔注射嗜水气单胞菌后首次死亡出现在12小时后。60小时后死亡率趋于恒定。所有死亡鱼都出现了烂尾和烂鳃及出血性败血症现象(Roberts等,1997)。实验记录了注射菌后5天内的累积死亡率,并在第六天计算存活率,结果如图3所示。存活率最高组为摄食75 g/kg饲料脂质的草鱼组。0 g/kg脂肪组的草鱼存活率最低(P <0.05)。

3.4 草鱼注射嗜水气单胞菌前后的非特异性免疫应答活性
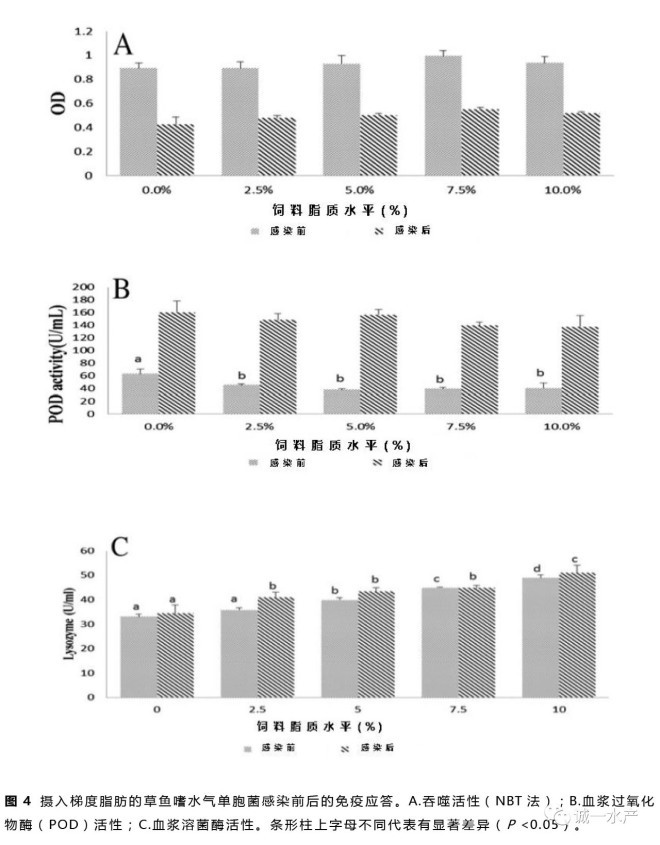
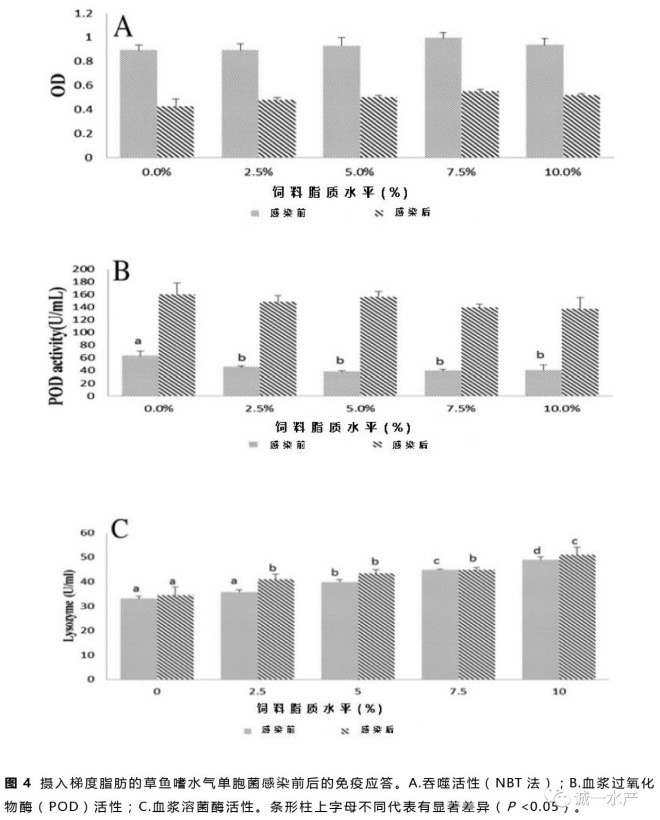
非免疫应答如吞噬活性、血浆过氧化物酶(POD)活性及血浆溶菌酶活性如图4所示。感染前,吞噬活性随着饲料脂质水平的提高而出现上升趋势,在75 g/kg饲料脂质组出现最高峰值。感染后,吞噬活性显著降低至应激前一半的水平(图4A)。0 g/kg饲料脂质组的POD活性显著高于其它各组(P <0.05);感染后,各组POD活性都显著高于其应激前水平(图4B)。饲料脂质的增加显著提高了草鱼血浆溶菌酶活性(P <0.05),感染后溶菌酶活性只是略微有所上升(图4C)。
4、讨论
4.1 饲料脂质水平与生长
本实验中,摄食含脂饲料的草鱼增重率显著高于无脂对照组(P <0.05),与之前一些研究报道的增加饲料脂质含量会促进鱼类生长的结论一致(Watanabe等,1982)。饲料脂质含量与草鱼生长的关系通过二项式回归分析如图1所示,最大值出现在饲料脂质含量为65.3 g/kg的时候。值得注意的是25 g/kg饲料脂质组的草鱼增重率与50 g/kg、75 g/kg和100 g/kg饲料脂质组的草鱼增重率没有显著差异(表2),说明在饲料脂质含量达到25 g/kg后已经满足了草鱼最低脂肪需求量。本实验中最佳草鱼饲料脂质含量高于Du等(2005)报道的含量,可能是因为本实验的养殖水温相对较高且草鱼生长较快,全程未出现厌食现象。
、
从表2中可见蛋白质效率在50 g/kg饲料脂质组中达到最大值2.69,在75 g/kg和100 g/kg饲料脂质组保持稳定,间接支持了适当的脂肪含量可节约饲料蛋白的理论(Dias等,1998)。此外,过量的饲料脂质会导致草鱼体脂的沉积。草鱼全鱼脂肪含量与饲料脂质含量的正相关关系(表3)表明,当饲料脂质含量超过草鱼需要量后,一部分脂质会转化成全鱼脂肪沉积下来。同样的结果在其它鱼种中也有报道,如虹鳟(Lee等,1973)、斑点叉尾鮰(Garling等,1977)、鲤鱼(Takeuchi等,1979)、红鼓鱼(Ellis等,1991)和杂交胡鲶鱼(Jantrarotai等,1994)。

4.2 饲料脂质水平与免疫和健康
在过去三十年的研究中发现饲料营养成分包括一些添加剂可刺激鱼类免疫系统并提高抗病能力(Viswanath,2012)。在本实验中,设计了5种等氮梯度脂质饲料来评估草鱼抗感染抗病能力,结果表明饲料脂肪会影响草鱼免疫应答。
在鱼类抵抗疾病中,非特异性免疫比特异性免疫更重要(Anderson,1992)。吞噬细胞一个重要的抗菌应答是活性氧(ROS)产物(Eo等,2008)。本实验结果显示吞噬细胞活性氧产物随着饲料脂质含量的增加而增加,但是当饲料脂质含量超过75 g/kg后会略微下降(图4A)。在欧洲鲈中也发现了相同的现象(Sitjà-Bobadilla等,1999)。溶菌酶被广泛用作鱼类的免疫指标(Ortuneo等,2000)。它由白血球分泌并发挥重要的抗菌活性。以往的试验中溶菌酶活性和脂质的补充表现出了正相关的关系(Li等,2012),本次实验中也表现出了相似的正相关关系(图4C)。POD是消除活性氧的抗氧化酶,因此当鱼类应激后其POD活性会有所增加(Raico等,2005)。本实验中摄食无脂对照饲料组的草鱼POD活性最高,摄食50~75 g/kg饲料脂质组的草鱼POD活性最低,当草鱼感染嗜水气单胞菌后,所有组的POD活性急剧增加(图4B)。该结果表明无脂饲料比过量高脂饲料更能引起草鱼机体应激反应。

营养养殖实验后常常通过病菌感染实验来评估鱼体的健康(Lim等,2009)。实际养殖中常见的嗜水气单胞菌经常被用在营养免疫实验中,感染嗜水气单胞菌后会出现出血性败血症状及溃疡性病变。在实际养殖中嗜水气单胞菌感染也是淡水鱼养殖高死亡率的原因之一,造成了巨大的经济损失(Jiravanichpaisal等,2009)。如图3所示,在嗜水气单胞菌感染后,无脂对照组草鱼的存活率最低,说明饮食中的脂质一定程度上提高了抗病能力。在早期欧洲海鲈及武昌鱼的实验中都出现了一致的结果(Li等,2012)。也有研究报道表明饲料脂质水平对罗非鱼抗链球菌(S. iniae)感染没有影响(Lim等,2009),在斑点叉尾鮰摄食不同脂质水平(0~90 g/kg)饲料后进行的爱德华氏菌感染实验中,结果也没有出现差异(Yildirim-Aksoy等,2009)。实验结果的差异可能是由于实验鱼种不同、大小不同、饲料脂质源不同、投喂率不同或养殖条件不同等原因造成(Li等,2012)。在大西洋鲑鱼的相关研究中发现摄食鱼油的鱼比摄食菜籽油的鱼在迟缓爱德华氏菌感染实验中的存活率更高(Carter等,2003)。在大西洋鲑鱼用葵花油不同程度的替代鱼油实验中,迟缓爱德华氏菌感染后累积死亡率出现了显著差异(Bransden等,2003)。斑点叉尾鮰的一个早期实验指出饲料脂质(鲱鱼油和亚麻籽油)在高温情况下(28℃对比17℃)影响爱德华氏菌感染后的死亡率(Fracalossi等,1994)。
本实验中,在嗜水气单胞菌感染下摄食75 g/kg饲料脂质组的草鱼存活率最高,当饲料脂质水平上升到100 g/kg时,存活率有所下降(图3),表明过量的饲料脂质不利于草鱼非特异性免疫系统,可能是由于过量的脂质对肝脏造成了破坏。
谷草转氨酶和谷丙转氨酶是鱼体内重要的转氨酶,常被用作鱼类健康指标,有效体现肝脏的受损状态(Sheikhzadeh等,2012)。本实验中,血浆谷草转氨酶和谷丙转氨酶活性在摄食50~75 g/kg饲料脂质组的草鱼中最低(表4),表明饲料脂质水平在60 g/kg左右时对草鱼肝脏功能的影响最小。此外谷草转氨酶和谷丙转氨酶活性在摄食无脂对照饲料和100 g/kg脂质水平饲料的草鱼中显著升高,说明无脂或高脂都会因为加重代谢负担而影响草鱼肝脏的正常功能(Hevrøy等,2004)。同样的结果在之前的草鱼幼鱼实验(Lin等,1990)及武昌鱼实验(Li等,2012)中也有发现。

血浆碱性磷酸酶活性同样被用于评估肝脏的损伤程度(Venkateswara,2006)。当肝脏碱性磷酸酶活性降低或血浆碱性磷酸酶活性升高都可作为肝脏薄壁组织的损伤的标志之一。本实验中,血浆碱性磷酸酶活性在无脂对照组中最高(表4),表明无脂饲料对肝脏的损害可能高于高脂饲料。碱性磷酸酶活性随着饲料脂质水平升高而下降可能是由于草鱼逐渐适应了高脂饲料(Banaee等,2011)或者转磷酸活性下降(Sharma,1990)。
氧化应激往往是因为活性氧产物的产生和消除不平衡造成的(Tocher等,2002)。一般来说,鱼类的抗氧化防护受营养因子的影响较大(Sheikhzadeh等,2012)。本实验中,肝脏丙二醛(MDA)含量随着饲料脂质含量的升高而缓慢上升(图2A),表明草鱼对脂肪酸过氧化反应的敏感性上升(Stéphan等,1995)。在草鱼摄食不同脂肪源的高脂饲料中(Du等,2008)及武昌鱼摄食不同糖脂比的饲料实验中(Li等,2012)也出现了相似结果。相反,总抗氧化酶(T-AOC)活性随着饲料脂质水平的提高而显著降低(图2C),表现出剂量依赖性,说明草鱼抗氧化能力显著受饲料脂质含量的影响且T-AOC活性在今后的研究中可作为鱼类免疫应答的指标之一。虽然各组间肝脏超氧歧化酶(SOD)活性没有显著性差异,但是摄食较高饲料脂质的草鱼肝脏SOD活性出现上升的趋势(图2B)。SOD做为一种抗氧化酶可催化两个超氧自由基经过歧化作用变成过氧化氢和氧气来消除过氧化物(Fattman等,2003)。总的来说,本实验中肝脏氧化及健康指标MDA、SOD和T-AOC所表现出来的趋势表明高脂饮食的草鱼氧化程度高。
本实验中血浆甘油三酯和总胆固醇含量随着饲料脂质水平的升高而升高(表4)表明饲料脂质水平的提高使得草鱼内源性脂肪转运更活跃。该结果在之前的研究中也有类似报道(Du等,2005),表明高饲料脂质水平可能加重肝脏代谢负担。
5、结论
从本实验结果可知适量的饲料脂质水平可促进草鱼机体免疫能力,但是过量的饲料脂质水平会加重肝脏氧化程度。从实用角度看,本实验结果建议在正常的养殖状态下草鱼饲料脂质含量以65.3 g/kg为佳,但是在特殊时期尤其是疾病易发时期,适当提高饲料脂质含量是十分必要的。该时期可将脂肪含量提高到75 g/kg来提高草鱼抗应激能力。(完)
1、来源:《中大水生通讯》第59期
2、作者:中山大学生命科学学院水生经济动物研究所 金艳/文
3、微信号:gzchengyi2013





