
摘要
以新鲜鱼油(过氧化值为11.5 meq/kg)和3种不同氧化程度的氧化鱼油(过氧化值分别为132,277和555 meq/kg)为脂肪源,设计了4组等氮等脂饲料,分别是新鲜鱼油组(对照),氧化鱼油组OX132,OX277组和OX555组,通过12周的养殖实验,评定了饲料中鱼油氧化对大口黑鲈幼鱼生长、血液生化指标、肝脏抗氧化性能及肝组织结构的影响。实验结束时,OX277组和OX555组均有约3%的鱼显现头盖骨或脊椎骨畸形症状,以及约9%的鱼显现了背鳍、胸鳍和尾鳍糜烂充血的症状。与新鲜鱼油组相比,氧化鱼油组摄食增加,其增重率和特定生长率因此也增加。饲料中鱼油氧化也会改变大口黑鲈的形态学参数和机体营养组成。摄食氧化鱼油后,大口黑鲈肝脏的过氧化氢酶(CAT)和超氧化物歧化酶(SOD)的活性增加。OX555组肝脏的谷胱甘肽过氧化物酶(GPX)、谷胱甘肽还原酶(GR)和谷胱甘肽-S-转移酶(GST)活性均高于其它各组,而其肝脏的还原性谷胱甘肽(GSH)的含量则低于其它各组。氧化鱼油的添加还会导致血浆和肌肉的丙二醛(MDA)含量上升,血细胞比容下降。肝组织切片显示,OX277组和OX555组肝细胞充满脂滴,细胞核偏位甚至消失。本实验结果表明,摄食氧化鱼油导致的氧化损伤刺激了大口黑鲈肝脏的抗氧化防御,削弱了还原性物质储备,并能诱导特征性病理症状的出现。鱼油氧化对大口黑鲈幼鱼健康的危害及其导致的出乎意料的摄食量增加预示着应尽可能防止饲料脂肪氧化的重要性。
1、前言
鱼类不具备将C18脂肪酸去饱和、延长并合成EPA和DHA的能力或合成能力不足(Mourente等,2000),因此必须在水产饲料中额外添加一定量的高不饱和脂肪酸HUFAs来满足其正常生长发育的需要(Sargent等,1999)。然而,在金属离子、光照、分子氧和热的介导下,这些机体所需的多不饱和脂肪酸PUFAs(如亚麻酸和亚油酸)和HUFAs(如花生四烯酸、EPA和DHA)极易遭受自由基链式反应而发生脂质过氧化,产生一系列不稳定的初级烷基过氧化产物(Frankel,1998),不稳定的初级氧化产物经过链的断裂崩解,进而生成一系列的稳定的次级氧化产物——小分子醛酮化合物(Howell等,1998)。初级氧化产物通常并不影响油脂的颜色和气味,而次级氧化产物则决定了油脂酸败的特征性臭味和颜色改变(Howell等,1998)。脂质氧化所产生的烷基自由基和小分子活性化合物不但能攻击细胞膜的PUFAs,还能与蛋白质氨基和DNA的碱基发生反应,形成交联复合物,改变细胞膜流动性,导致基因毒性以及蛋白质和酶类功能障碍(Janssens等,2000)。与初级脂质过氧化产物和自由基不同,小分子活性醛酮化合物不但能在细胞内攻击细胞成分,还能扩散和转移至细胞外,危害其它组织细胞(Halliwell等,2000)。因此,无论是PUFAs氧化产生的初级氧化产物,还是次级氧化产物,都会对鱼体生长发育和正常健康带来危害。
虽然时刻面临着脂质过氧化的压力,但水产动物也具备强有力的抗氧化防御系统来保护机体免遭自身正常代谢过程中所产生的自由基攻击。鱼类的抗氧化防御系统既包括内源性的抗氧化酶类如CAT、SOD、GPX、GST、GR,也包括内源性的抗氧化物质如辅酶ⅠNADH、辅酶ⅡNADPH、GSH、巯基基团等,还包含从外源性食物中获取的还原性物质如类胡萝卜素、VE、VC、VA、硒等(Fontagné等,2006)。在实际生产之中,人工合成的抗氧化剂如乙氧喹(EQ)、丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)等亦可能被添加到水产饲料中以防止饲料脂肪发生氧化酸败(Hung等,1981)。鱼类对酸败脂肪的抵抗能力除了具有种间差异外(Tocher等,2003),还与实验鱼所处生长阶段、试验周期、添加的氧化脂质的含量、氧化脂质的初级氧化产物与次级氧化产物比例等因素密切相关(Tabatabaei等,2008)。当水产动物机体的抗氧化与过氧化的稳态被打破后,随着脂质过氧化物的积累和对组织细胞的毒害作用的加剧,可能会导致鱼虾摄食量下降(Hamre等,2001),骨骼畸形(Fontagné等,2006),生长受阻和饲料利用效率下降,肌肉营养不良,肝组织变性,色素沉积紊乱(Sargent等,2002)。
大口黑鲈原产北美洲,在湖泊和河流中均有分布(Coyle等,2000)。在1983年引种入我国广东省后,其养殖区域迅速扩散到浙江省、江苏省、四川省等省份。由于具备生长快、营养价值高、肉质鲜美和市场价值高等优点,大口黑鲈已经成为我国重要的淡水经济鱼类之一。Subhadra等(2006)也推测大口黑鲈具备极为有限地将C18脂肪酸转化为HUFAs的能力,因此饲料中需要额外添加相当量的HUFAs。大口黑鲈的脂肪需求量较高,约为10%~15%(Portz等,2001),饲料中的脂肪容易发生氧化酸败。在实际生产中,饲料的膨化加工的高热处理也会导致饲料脂质过氧化。目前,关于摄食氧化油脂对大口黑鲈生长和健康状态的研究鲜有报道,因此本研究采用鱼油为唯一脂肪源,人工制作氧化鱼油,配制了不同氧化程度的氧化鱼油饲料,着重考察脂肪氧化酸败对大口黑鲈肝脏抗氧化防御和组织学形态结构的影响。
2、材料与方法
2.1 实验饲料
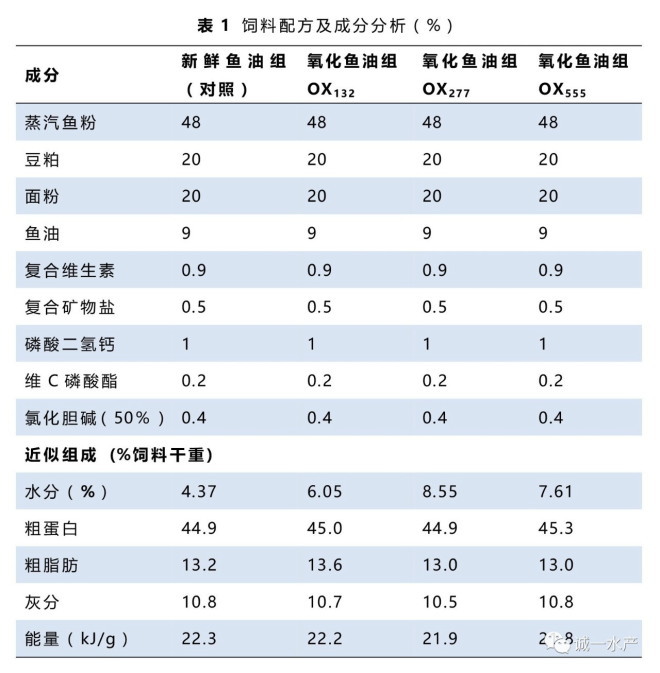
本实验共配制了4组等氮等脂饲料(表1),除添加鱼油的品质不同外,4组饲料的其它成分完全一致。新鲜鱼油组(对照)添加新鲜鱼油,3个氧化鱼油组OX132、OX277和OX555组分别使用过氧化值为132、277和555 meq/kg的鱼油。氧化鱼油的制作过程为:将新鲜鱼油(过氧化值=11.5 meq/kg)置于50℃水浴锅中加热并连续充气,定期取样检测过氧化值,待过氧化值达到132、277和555 meq/kg时,收集适量的氧化鱼油于-20℃冷冻保存。使用小型双螺杆膨化机制作饲料,饲料经自然风干至水分含量低于10%,于-20℃冰柜中保存。
2.2 实验鱼及饲养管理
实验鱼购买于顺德一家私营大口黑鲈鱼苗场,平均体重约为1 g。实验鱼苗驯化1个月后,将约600尾转移至室内循环水族箱系统(12个×500 L)暂养2周;驯养后期和暂养期间均投喂对照组饲料。暂养结束,选取健康、大小均一的鱼,每箱35尾,平均初始体重为5.12±0.02 g。每种饲料随机投喂3个箱,每天饱食投喂2次(9:00和16:00)。实验周期为12周,期间水温为27.8±1.6℃,溶氧为8.81±0.39 mg/L,氨氮为0.16±0.02 mg/L,pH为7.86±0.33。
2.3 计算公式
存活率(%)=终末鱼尾数×100/初始鱼尾数;
摄食量(FI,g/尾)=每尾鱼所摄食的饲料干重;
增重率(WG,%)=(终末鱼重–初始鱼重)×100/初始鱼重;
特定生长率(SGR,%/d)=(ln终末鱼重– ln初始鱼重)×100/实验天数;
饲料效率(FER)=(终末鱼重–初始鱼重)/饲料摄入量;
蛋白质效率(PER)=(终末鱼重–初始鱼重)×100/蛋白质摄入量;
肥满度(CF)=体重×100/体长(cm)3;
脏体比(VSI,%)=内脏重×100/体重;
肝体比(HSI,%)=肝重×100/体重;
脂体比(IPF,%)=肠系膜脂肪重×100/体重;
脾体系数(SSI,%)=脾脏重×100/体重。
其中,初始鱼重(IBW)和终末鱼重(FBW)的单位为g/尾。
2.4 统计分析
所有数据均以“平均值±标准差”形式表示,使用SPSS 11.5统计软件对所有数据进行单因素方差分析,采用Duncan’s多重比较检验均值的差异显著性,鱼油氧化指标的相关性使用Pearson相关系数进行检验,显著性水平均为0.05。
3、实验结果
3.1 鱼油的氧化状态
如表2所示,随着鱼油的过氧化值升高,氧化鱼油的酸价也显著增加(P<0.05),次级氧化产物的指标MDA含量和p-AnV也显著增加(P<0.05)。将其它氧化指标与过氧化值相关分析发现,MDA与过氧化值显著正相关(P<0.05),酸价和p-AnV与过氧化值均为极显著正相关(P<0.01)。
3.2 生长、饲料利用及形态学参数
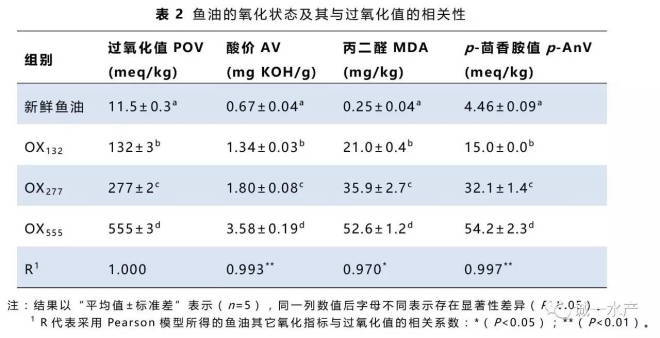
12周实验结束时,各组存活率均大于90%,但OX555组仍然显著低于其它3组(P<0.05)。OX277和OX555组均有约9%的鱼背鳍、胸鳍和尾鳍基部出现糜烂充血病理症状,约3%的鱼头盖骨或脊柱均发生畸形症状(图1)。如表3所示,所有氧化鱼油组的增重率、特定生长率和摄食量都显著高于对照组(P<0.05),而氧化鱼油组之间差异不显著。饲料效率和蛋白质效率随着鱼油过氧化值的升高逐渐下降,在OX555组均显著低于对照组(P<0.05)。鱼油的氧化还会导致大口黑鲈幼鱼的形态学参数发生改变,随着鱼油过氧化值增加,肥满度和肝体比呈现下降趋势,脂体比和脏体比先升高后降低,肥满度、肝体比分别在OX555组和OX277组显著最低,而OX132组的脂体比显著最高(P<0.05),OX132组的脏体比显著高于其它2个氧化鱼油组(P<0.05)。另外,所有氧化鱼油组的脾体系数都显著高于对照组(P<0.05)。

3.3 全血免疫参数和血浆生化参数
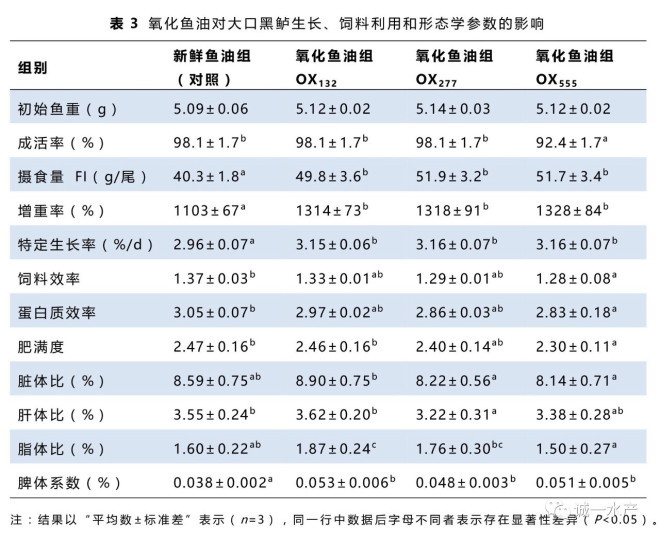
如表4所示,全血血红蛋白含量不受氧化鱼油影响,但血细胞比容随着鱼油过氧化值增加而逐渐下降,在OX555组显著低于对照组(P<0.05)。随着鱼油过氧化值增加,氧化鱼油组血浆的胆固醇、低密度脂蛋白含量逐渐增加,均在OX555组显著最高(P<0.05)。血浆甘油三酯和高密度脂蛋白含量在各组间差异不显著。
3.4 肝脏抗氧化防御
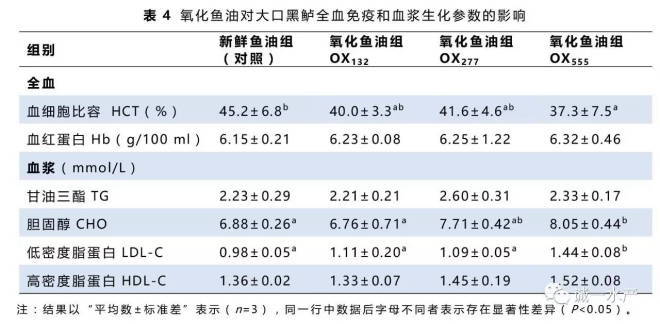
肝脏抗氧化酶活性数据如表5所示。与对照组相比,氧化鱼油的添加会促使肝脏抗氧化酶活性上升和还原性物质含量的消耗。当鱼油过氧化值超过132 meq/kg时,大口黑鲈肝脏的CAT和SOD活力显著增加(P<0.05);当鱼油过氧化值为555 meq/kg时,大口黑鲈肝脏的GPX、GR和GST的活性显著上升(P<0.05);而当鱼油过氧化值超过277 meq/kg时,大口黑鲈肝脏的GSH含量则显著下降(P<0.05)。
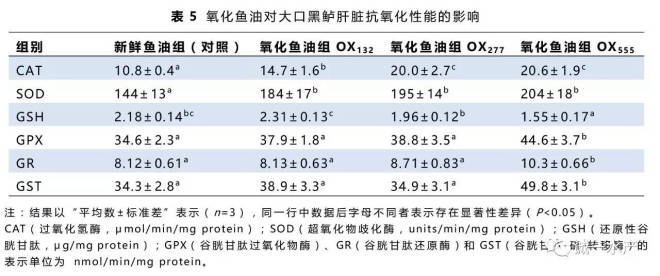
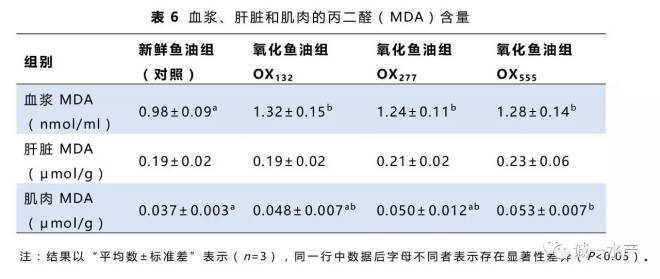
3.5 血浆、肝脏和肌肉的丙二醛含量
如表6所示,与对照组相比,所有氧化鱼油组的血浆MDA含量均显著增加(P<0.05)。肝脏的MDA含量不受实验处理显著影响。肌肉MDA含量随鱼油过氧化值升高而逐渐增加,仅在OX555组显著增加(P<0.05)。
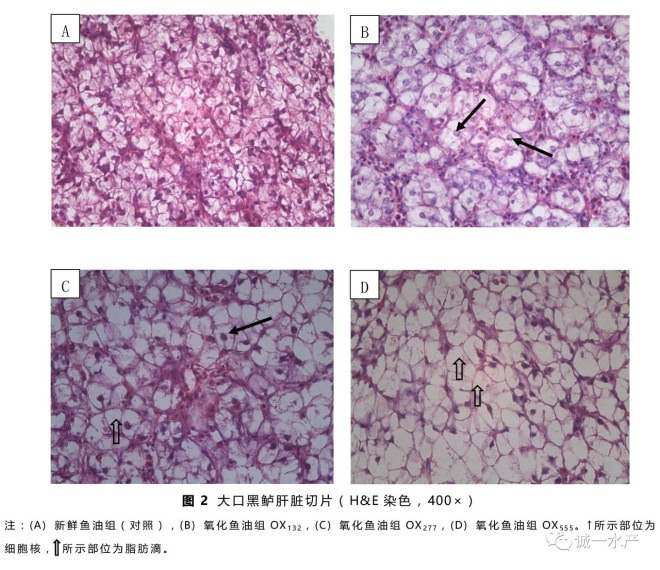
3.6 肝脏切片
图2所示为肝组织的H&E染色切片。对照组的肝细胞分布较为均匀,细胞核排列较为整齐。氧化鱼油组OX132的肝细胞体积增大,细胞肿胀,细胞核排列比较整齐;而OX277组和OX555组的肝细胞则充满脂肪滴,细胞核受到挤压偏位,甚至消失。
4、讨论
鱼油氧化酸败后,其过氧化值升高,酸价、MDA和p-AnV也逐渐增加,预示着鱼油氧化后其初级和次级氧化产物含量均逐渐增加。同时,在氧化鱼油的制作过程中,鱼油呈色中黄色的比例增加,出现恶臭味,这与Tabatabaei等(2008)通过类似方法获取氧化鱼油的结果类似。
在本实验中,氧化鱼油的添加出乎意料地促进了大口黑鲈幼鱼的生长,但有研究显示,氧化油脂的添加不影响幼鱼生长(Lewis-McCrea等,2007),或削弱生长性能(Fontagné等,2006),与本实验结果不同。唯一与本结果相似的是在海鲷中的研究,摄食添加氧化鱼油的饲料,海鲷的生长比新鲜鱼油组有增加的趋势(Tocher等,2003)。本实验中,氧化鱼油组生长的增加是由于摄食量增加所致,这与普遍认为的油脂氧化会导致饲料的适口性降低有所矛盾(Fontagné等,2006)。鱼油氧化促使大口黑鲈摄食增加的原因可能来自以下三方面:一是鱼油氧化酸败产生的氧化产物损害了大口黑鲈幼鱼的正常的摄食反馈调节机制;二是饲料制作过程中,其它饲料成分对氧化产物的稀释或还原性物质与氧化产物的中和反应稀释了鱼油氧化的毒性效应;三是不同鱼种对氧化油脂的耐受度各不相同。在本实验饲料制作过程之中,从人的嗅觉角度上讲,鱼油氧化酸败的恶臭味在原料混合和饲料颗粒成型后消失无踪。另外,海鲷(Tocher等,2003)、大西洋鲑(Hamre等,2001)和大西洋鱈(Zhong等,2008)亦不具备区分新鲜鱼油和氧化鱼油的能力。除大口黑鲈之外,本研究团队还发现氧化鱼油还会促进石斑鱼(Epinephelus coioides)增加摄食。本实验中,氧化鱼油组的饲料效率和蛋白质效率随鱼油过氧化值增加而下降,原因可归结为脂质氧化产物的毒害作用和(或)摄食量增加而引起的饲料利用效率降低。
在本实验中,摄食过氧化值为555 meq/kg的氧化鱼油组的死亡率(约8%)高于新鲜鱼油组,同样,摄食氧化鱼油也会导致黄鰤鱼(Murai等,1998)、黑鲷(Acanthopagrus schlegeli)(Peng等,2009)、虹鳟(Cowey等,1984)等鱼种的死亡率增加。与大西洋庸鲽(Lewis-McCrea等,2007)和西伯利亚鲟(Fontagné等,2006)的研究类似,大口黑鲈摄食过氧化值超过277 meq/kg的氧化鱼油时,会出现一定比例的脊柱畸形症状,此外,头盖骨畸形亦为大口黑鲈摄食氧化鱼油的另一畸形特征。但在本实验中,并未观察到大口黑鲈呈现渗出性素质、肌肉营养不良、表皮脱色和黄疸病等症状(Murai等,1974),可能与本实验周期较短有关。摄食氧化鱼油除了导致骨骼畸形外,OX277和OX555组均约有9%的大口黑鲈的背鳍、胸鳍和尾鳍基部出现糜烂充血病理症状。
与在黑鲷中的研究结果类似(Peng等,2009),摄食氧化鱼油也导致了大口黑鲈肥满度的降低。在本实验中,OX277组的肝体比显著低于新鲜鱼油组和OX132组。Zhong等(2008)报道,饲料中添加过氧化值为94 meq/kg的氧化鱼油并不影响大西洋鱈的脏体比和肝体比,但在黑鲷的研究中,饲料中添加过氧化值为45 meq/kg的氧化鱼油则导致了肝体比增加(Peng等,2009),然而在黄鰤鱼的研究中,氧化鱼油的添加却降低了肝体比(Sakaguchi等,1969)。不同实验的结果不尽相同的原因可能为添加的氧化油脂的初级与次级氧化产物比例不同,实验周期长短不一致,以及特定鱼种对氧化油脂的忍耐程度不一样。在本实验中,高氧化度鱼油组的形态学参数下降可能为次级氧化产物的累积毒性效应所致。
在以往的研究报道中,鱼类摄食氧化油脂后通常伴随着其组织MDA含量增加(Peng等,2009)。在本实验中,大口黑鲈摄食氧化鱼油后其血浆和肌肉MDA含量增加。摄食氧化脂质后,组织MDA含量的上升可能源自于吸收的MDA增多,也可能来自吸收的脂质过氧化物后续的断裂分解(Hamre等,2001)。肝脏的MDA含量要比肌肉的高,因为肝脏作为脂肪代谢中心更易面临脂质过氧化压力和脂质氧化产物的攻击。MDA含量也是衡量水产品保质期的可靠指标(Gatta等,2000),本实验中添加氧化鱼油导致了肌肉MDA含量增加,预示着肌肉品质的下降。在非洲鲶(Clarias gariepinus)的研究中,饲料脂肪氧化酸败缩短了鱼片在低温保存过程中的保质期(Baker,1997)。
本实验中,氧化鱼油的添加促进了大口黑鲈肝脏的CAT和SOD活力增加。与此同时,相比新鲜鱼油组,OX555组肝脏的GPX、GR和GST的活性也显著增加,而GSH含量则显著下降,预示着其抗氧化防御的平衡已被打破。大口黑鲈摄食氧化鱼油后脾体系数的增加也说明脂质过氧化可能刺激了免疫性能的提升。与本实验结果一致,氧化脂质的添加也诱导了海鲷和大菱鲆肝脏的CAT、SOD、GPX、GST和GR活性的增加(Tocher等,2003),刺激了黄鰤鱼肝组织的SOD和GPX的活力增加(Sakai等,1992),以及导致了罗非鱼肝脏的GSH含量下降(Huang等,2004)。肝脏的抗氧化酶活性的增加可能清除了本实验中添加氧化鱼油对肝脏所施加的脂质过氧化压力,因而肝脏的MDA含量并未受到鱼油氧化的影响。除此之外,氧化油脂所含的MDA亦可能在饲料制作和储存的过程中被饲料中的还原性物质中和(Messager等,1992)。大口黑鲈摄食氧化鱼油后其血浆MDA含量增加,可能影响了血细胞的正常功能,导致血细胞比容下降。Cowey等(1984)也报道,脂肪酸败会诱导鱼类血细胞比容下降。
组织学切片观察表明,OX277和OX555组的肝组织细胞发生了变性症状,出现了脂滴浸润和细胞核偏位或消失的现象,而OX132组的肝组织细胞则出现了肿大症状。在本实验12周的养殖周期下,大口黑鲈似乎能够忍受饲料中添加过氧化值低于132 meq/kg的氧化鱼油而不出现明显的病理症状。
5结论
大口黑鲈摄食氧化鱼油后会刺激其肝脏抗氧化防御,消耗其组织的还原性物质储备,组织脂质过氧化压力增加进而诱导鳍条充血和骨骼畸形的典型症状。而令人意外的是,添加氧化鱼油促进了大口黑鲈摄食,这加剧了机体对脂质氧化产物的摄入和氧化产物的累积毒害作用,因此应尽可能地预防饲料中脂肪发生氧化酸败。(完)
1、来源:《中大水生通讯》第59期
2、作者:中山大学生命科学学院水生经济动物研究所 陈拥军/文
3、微信号:gzchengyi2013






